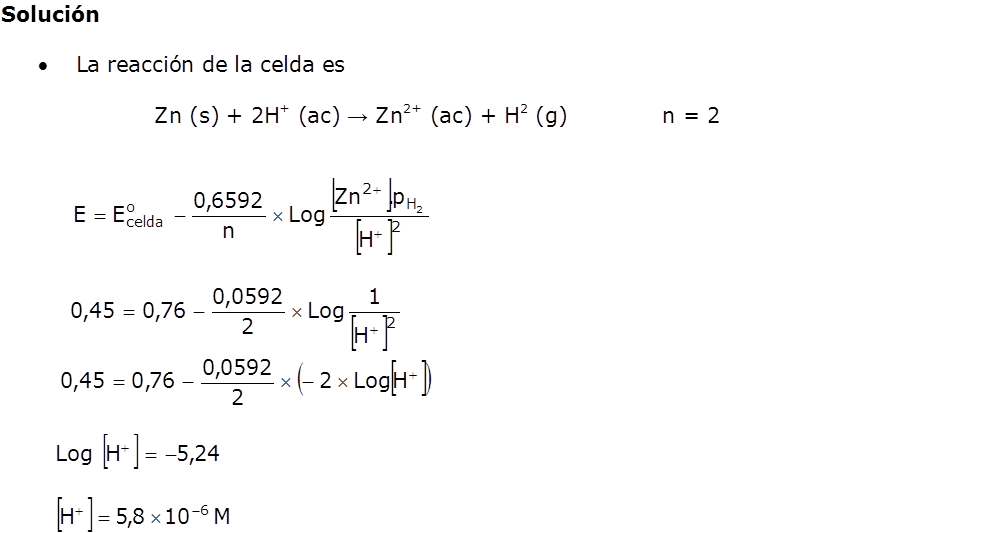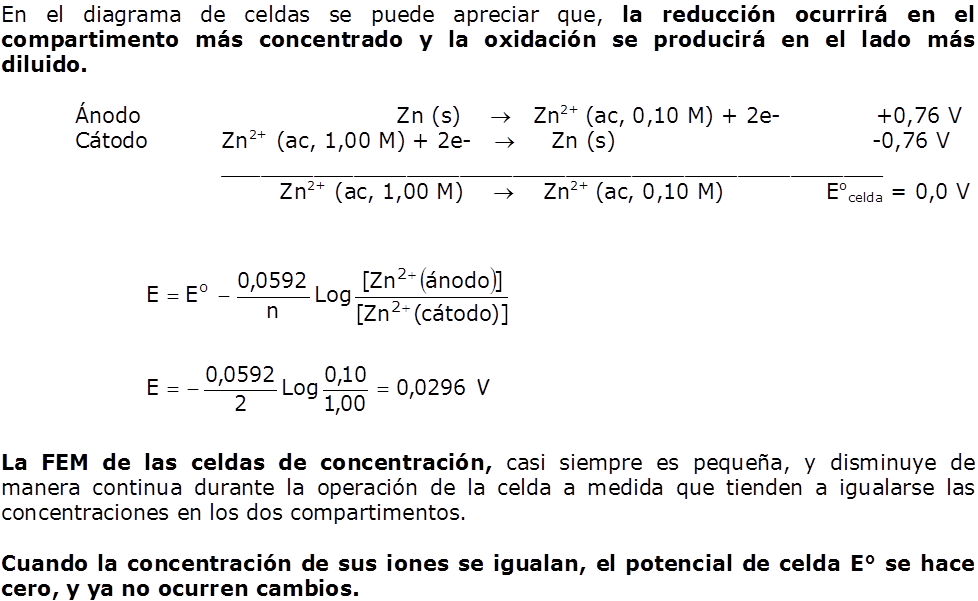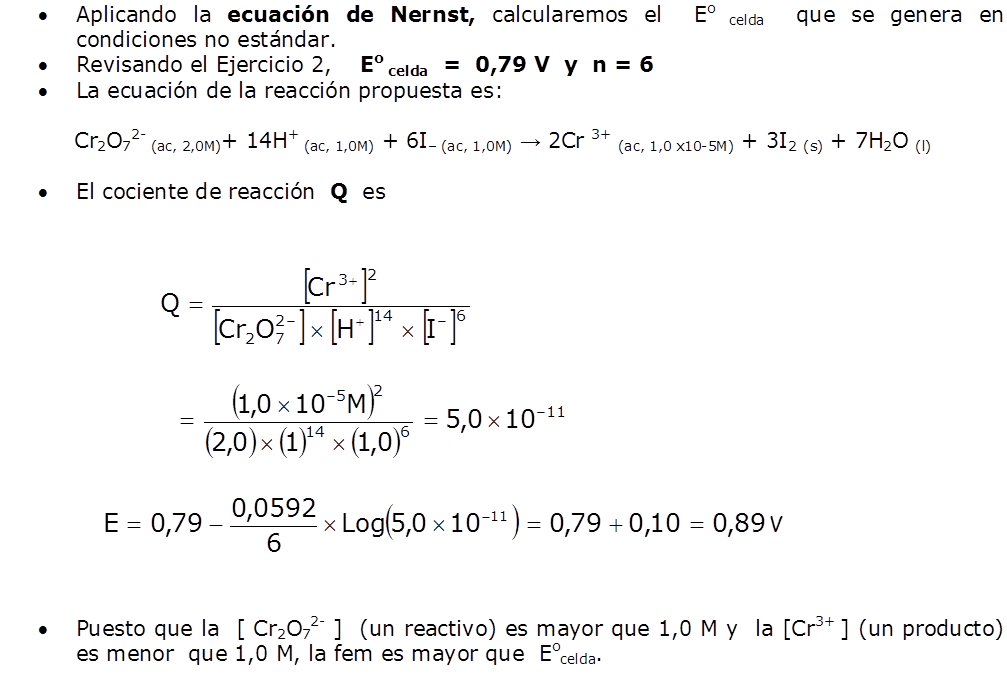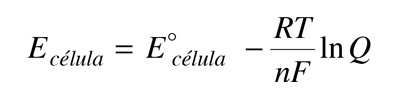13 Celda Galvanica - U3. TEMA 3 ELECTROQUÍMICA 1: CELDAS GALVÁNICAS 3 CELDAS GALVÁNICAS : - Studocu

Electroquímica 8: Ecuación de Nernst y cálculos de potencial de celda en condiciones no estándar - YouTube

Hasta ahora hemos calculado el potencial de la pila en condiciones estándar. En este apartado aprenderemos a calcularla en otras condiciones, por ejemplo, cuando las concentraciones de las sustancias que intervienen son distintas a 1 M.